巴西,南美大陆的经济巨擘,以其丰富的自然资源和不断完善的经济结构,稳坐第五把交椅,展现了南美洲经济的活力与潜力。巴西人口规模2亿多,2023年全年GDP增长2.9%,国内生产总值2.19万亿美元,人均国内生产总值10079美元。
作为拉丁美洲人口排名第一的国家,巴西是当下医疗器械出海最火热的市场之一,也成为南美洲最大的医疗器械市场。
从2023年开始,中国医疗器械产品在巴西新注册的产品数量剧增,2024年,中国产品在巴西新增医疗器械注册中占比近30%。在地球的另一端,中国医疗器械产品正在密集登陆巴西市场。
 巴西国家卫生监管机构(ANVISA):是巴西联邦政府卫生部属下的卫生监管机构,也是巴西医疗器械、化妆品、保健品注册和审批的主要机构,负责批准医疗器械的销售和使用许可,它将用于健康的材料,骨科植入物和体外诊断统称为医疗器械。只有经过注册之后的医疗器械才被允许在巴西销售和使用。
巴西国家卫生监管机构(ANVISA):是巴西联邦政府卫生部属下的卫生监管机构,也是巴西医疗器械、化妆品、保健品注册和审批的主要机构,负责批准医疗器械的销售和使用许可,它将用于健康的材料,骨科植入物和体外诊断统称为医疗器械。只有经过注册之后的医疗器械才被允许在巴西销售和使用。
巴西医疗器械认证分类
根据风险等级将医疗器械分为四类(Class I, II, III, IV),风险等级越高,监管要求越严格:
- Class I: 低风险(适用于低风险的医疗设备,如绷带、手术手套等)
- Class II: 中低风险(适用于一定风险的医疗设备,如输液管、注射器等)
- Class III: 中高风险(适用于高风险的医疗设备,需要进行严格的临床评估和监管审批,如人工关节、牙科设备等)
- Class IV: 高风险(需通过最严格的测试和监管,如植入性心脏瓣膜等)
此外,巴西还根据产品的用途将医疗器械分为7个不同的类别:
(1)诊断类 (2)治疗和手术类 (3)植入和介入类
(4)体外诊断类 (5)Life support类 (6)康复类 (7)辅助类
监管法规:RDC 751/2022【2023年3月1日生效,类似MDR】、RDC 36/2015【IVD产品,将被新法规取代】。分类规则在RDC 751/2022的ANEXO I部分和RDC 36/2015的Seção II部分。
ANVISA负责医疗器械产品的上市许可授权;I、II类产品注册永久有效(除非被取缔),III、IV类产品10年有效,可以延续注册。
在巴西注册医疗器械对于境外公司来说是一个较为复杂的过程,需要遵循巴西的法规要求。以下是关于在巴西注册医疗器械的流程、注意事项、费用和时间的详细介绍,请咨询专业顾问了解最新变动。
一、注册流程
1. 巴西代表的授权:境外公司必须在巴西指定一个本地的法律实体作为其代表。这是因为巴西的国家卫生监督局(ANVISA)要求所有医疗器械的注册申请必须通过巴西的本地公司来提交。
2. 分类确定: 确定您的医疗器械属于哪一类。巴西的医疗器械分类与国际通用的分类大致相似,分为I、II、III和IV类。I类风险最低,IV类风险最高。
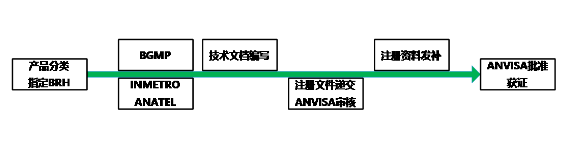
3. 准备注册文件
- 产品技术文件:包括产品描述、设计和制造信息、性能标准、风险分析等。
- 合规文件:如符合巴西技术法规的证书、临床评估(特别是高风险设备)、使用说明书等。
- 质量管理体系文件:对于II、III、IV类设备,通常需要提供符合ISO 13485或其他等效标准的质量管理体系文件。
4. 提交注册申请:通过ANVISA的在线系统提交申请。对于Class I和Class II设备,实施简易注册,注册申请被称为“Cadastro”,需向主管当局提交相关资料;对于Class III和Class IV设备,注册申请被称为“Registro”,需对工厂进行审核。
5. 文件审查:ANVISA将审查提交的文件。低风险设备(Class I和Class II)一般只需文件审查,获批后方可上市销售,市场授权有效期为永久;高风险设备(Class III和Class IV)可能需要进行进一步的技术审查和工厂检查,需取得巴西生产质量管理规范(BGMP)后才能提交主管当局进行产品注册,获批后方可上市销售。
6. 批准和注册证书:如果审查通过,ANVISA将颁发注册证书。注册证书通常有效期为10年,需要在到期前申请更新。
二、注意事项
- 语言要求:所有提交给ANVISA的文件必须为葡萄牙语。如果原始文件为其他语言,需提供经过认证的翻译件。
- GMP认证:对于Class III和Class IV设备,ANVISA要求制造商的工厂通过巴西GMP(良好生产规范)认证。这通常需要进行现场审查。
- 进口许可:即使产品获得注册,还需要申请进口许可才能合法进入巴西市场。进口许可由巴西卫生监管局的特定部门处理。
- 变化通知:任何产品或制造工艺的变化必须通知ANVISA,有时需要重新提交注册文件或申请更新。
- 市场监控和合规:在巴西销售的所有医疗设备必须遵守ANVISA的市场监控规定,定期报告设备的性能和安全问题。
总之,巴西的医疗器械注册流程相对复杂,建议与熟悉当地法规的法律代表或咨询公司合作,以确保合规并顺利完成注册。
三、费用和时间
1. 注册费用
费用由设备的分类(Class I, II, III, IV)和企业的规模决定(巴西国内企业通常有减免)。以下是一个大致的费用范围:
- Class I(低风险) 注册费约为 6,000 至 12,000 巴西雷亚尔(BRL)。
- Class II(中低风险) 注册费约为 8,000 至 16,000 巴西雷亚尔(BRL)。
- Class III(中高风险): 注册费约为 12,000 至 24,000 巴西雷亚尔(BRL)。
- Class IV(高风险): 注册费约为 18,000 至 36,000 巴西雷亚尔(BRL)。
注意: 这些费用是大致范围,具体费用可能会有所不同,且不包括文件翻译、咨询服务、GMP审查等额外费用。
2. 注册时间
注册时间也因设备分类和审核复杂性而异:
- Class I 和 Class II: 通常只需文件审查,注册时间较短,约 3 到 6 个月。
- Class III 和 Class IV: 由于需要更详细的技术审查,有时还需工厂检查,注册时间较长,可能需要 6 到 12 个月,甚至更长。
3. 其他费用和时间
- GMP认证费用: 如果设备属于 Class III 或 IV,制造商可能需要通过 ANVISA 的 GMP 审查。GMP 审查的费用大约在 30,000 到 50,000 巴西雷亚尔(BRL)之间。此外,还需考虑审查过程中可能产生的差旅和住宿费用。
- 文件翻译和法律服务: 所有文件必须翻译成葡萄牙语,认证翻译服务的费用以及法律代表的服务费应考虑在内。
- 进口许可申请时间: 注册完成后,申请进口许可通常需要额外的 1 到 2 个月。
总的来说,巴西的医疗器械注册流程可能相对耗时且费用较高,特别是对于高风险设备。在巴西注册医疗器械需要考虑到多方面的因素,包括法规要求、语言要求和本地代表的选择等。建议企业提前规划,并与经验丰富的法律代表或咨询公司合作,以确保顺利注册。
国内企业在进入巴西市场时,因应当地特殊规定,可采取三种不同的持证策略:
传统经销商持证模式:企业选择巴西市场的总经销商作为合作伙伴,该经销商负责发展二级代理网络,并承担医保经营及医生关系维护。国内企业能够利用经销商的资源快速启动销售,但面临的挑战在于经销商选择范围受限,且在更换经销商时需经过繁琐的自主申请或重新注册流程。此外,企业对巴西终端市场的控制力相对较弱。
第三方持证模式:第三方机构作为持证方,实现持证与经销的分离,代理商不再享有独家经销权。企业能够自由挑选和变更合作经销商,不受境外注册的限制,从而通过多家经销商覆盖更广阔的市场。这种模式特别适合于巴西这样地域辽阔的国家,有助于企业更灵活地拓展市场。
当地子公司持证模式:企业选择在巴西设立子公司,并进行当地注册,以实现对经销商的自由更换和对本土渠道的强有力控制。尽管这种模式的投入成本和运营管理成本较高,但对于长期深耕巴西市场的企业而言,是一个值得考虑的选择。例如,迈瑞医疗在巴西设立子公司,展示了这种模式的可行性和效益。
在全球监管审核梯队中,巴西相比于美国、欧美和日本准入门槛并不严苛,这为国内企业提供了更多的市场进入机会。
虽然巴西作为新兴市场,但其市场活力和潜力吸引着国内医疗器械企业进入。但盲目进入市场可能会遇到障碍。国内企业需要深度了解市场情况和需求后进入。
3. 准备注册文件
- 产品技术文件:包括产品描述、设计和制造信息、性能标准、风险分析等。
- 合规文件:如符合巴西技术法规的证书、临床评估(特别是高风险设备)、使用说明书等。
- 质量管理体系文件:对于II、III、IV类设备,通常需要提供符合ISO 13485或其他等效标准的质量管理体系文件。
4. 提交注册申请:通过ANVISA的在线系统提交申请。对于Class I和Class II设备,实施简易注册,注册申请被称为“Cadastro”,需向主管当局提交相关资料;对于Class III和Class IV设备,注册申请被称为“Registro”,需对工厂进行审核。
5. 文件审查:ANVISA将审查提交的文件。低风险设备(Class I和Class II)一般只需文件审查,获批后方可上市销售,市场授权有效期为永久;高风险设备(Class III和Class IV)可能需要进行进一步的技术审查和工厂检查,需取得巴西生产质量管理规范(BGMP)后才能提交主管当局进行产品注册,获批后方可上市销售。
6. 批准和注册证书:如果审查通过,ANVISA将颁发注册证书。注册证书通常有效期为10年,需要在到期前申请更新。
二、注意事项
- 语言要求:所有提交给ANVISA的文件必须为葡萄牙语。如果原始文件为其他语言,需提供经过认证的翻译件。
- GMP认证:对于Class III和Class IV设备,ANVISA要求制造商的工厂通过巴西GMP(良好生产规范)认证。这通常需要进行现场审查。
- 进口许可:即使产品获得注册,还需要申请进口许可才能合法进入巴西市场。进口许可由巴西卫生监管局的特定部门处理。
- 变化通知:任何产品或制造工艺的变化必须通知ANVISA,有时需要重新提交注册文件或申请更新。
- 市场监控和合规:在巴西销售的所有医疗设备必须遵守ANVISA的市场监控规定,定期报告设备的性能和安全问题。
总之,巴西的医疗器械注册流程相对复杂,建议与熟悉当地法规的法律代表或咨询公司合作,以确保合规并顺利完成注册。
三、费用和时间
1. 注册费用
费用由设备的分类(Class I, II, III, IV)和企业的规模决定(巴西国内企业通常有减免)。以下是一个大致的费用范围:
- Class I(低风险) 注册费约为 6,000 至 12,000 巴西雷亚尔(BRL)。
- Class II(中低风险) 注册费约为 8,000 至 16,000 巴西雷亚尔(BRL)。
- Class III(中高风险): 注册费约为 12,000 至 24,000 巴西雷亚尔(BRL)。
- Class IV(高风险): 注册费约为 18,000 至 36,000 巴西雷亚尔(BRL)。
注意: 这些费用是大致范围,具体费用可能会有所不同,且不包括文件翻译、咨询服务、GMP审查等额外费用。
2. 注册时间
注册时间也因设备分类和审核复杂性而异:
- Class I 和 Class II: 通常只需文件审查,注册时间较短,约 3 到 6 个月。
- Class III 和 Class IV: 由于需要更详细的技术审查,有时还需工厂检查,注册时间较长,可能需要 6 到 12 个月,甚至更长。
3. 其他费用和时间
- GMP认证费用: 如果设备属于 Class III 或 IV,制造商可能需要通过 ANVISA 的 GMP 审查。GMP 审查的费用大约在 30,000 到 50,000 巴西雷亚尔(BRL)之间。此外,还需考虑审查过程中可能产生的差旅和住宿费用。
- 文件翻译和法律服务: 所有文件必须翻译成葡萄牙语,认证翻译服务的费用以及法律代表的服务费应考虑在内。
- 进口许可申请时间: 注册完成后,申请进口许可通常需要额外的 1 到 2 个月。
总的来说,巴西的医疗器械注册流程可能相对耗时且费用较高,特别是对于高风险设备。在巴西注册医疗器械需要考虑到多方面的因素,包括法规要求、语言要求和本地代表的选择等。建议企业提前规划,并与经验丰富的法律代表或咨询公司合作,以确保顺利注册。
国内企业在进入巴西市场时,因应当地特殊规定,可采取三种不同的持证策略:
传统经销商持证模式:企业选择巴西市场的总经销商作为合作伙伴,该经销商负责发展二级代理网络,并承担医保经营及医生关系维护。国内企业能够利用经销商的资源快速启动销售,但面临的挑战在于经销商选择范围受限,且在更换经销商时需经过繁琐的自主申请或重新注册流程。此外,企业对巴西终端市场的控制力相对较弱。
第三方持证模式:第三方机构作为持证方,实现持证与经销的分离,代理商不再享有独家经销权。企业能够自由挑选和变更合作经销商,不受境外注册的限制,从而通过多家经销商覆盖更广阔的市场。这种模式特别适合于巴西这样地域辽阔的国家,有助于企业更灵活地拓展市场。
当地子公司持证模式:企业选择在巴西设立子公司,并进行当地注册,以实现对经销商的自由更换和对本土渠道的强有力控制。尽管这种模式的投入成本和运营管理成本较高,但对于长期深耕巴西市场的企业而言,是一个值得考虑的选择。例如,迈瑞医疗在巴西设立子公司,展示了这种模式的可行性和效益。
在全球监管审核梯队中,巴西相比于美国、欧美和日本准入门槛并不严苛,这为国内企业提供了更多的市场进入机会。
虽然巴西作为新兴市场,但其市场活力和潜力吸引着国内医疗器械企业进入。但盲目进入市场可能会遇到障碍。国内企业需要深度了解市场情况和需求后进入。
巴西国际医疗器材及医院用品展览会HOSPITALAR已成功举办 29 届,是巴西和拉美最具权威的医疗用品展览会。HOSPITALAR是拉美市场最大、最全面的医疗行业展会,圣保罗作为拉丁美洲的经济贸易中心,辐射了附近十余个国家均来参展。想要进入南美市场,HOSPITALAR是最好的机遇!
东信国际会展坚持专业化、国际化,突出服务优势,聚焦医疗器械、康复、实验室、生物技术及口腔等核心行业展会,包括德国MEDICA、迪拜Arab Health、巴西Hospitalar、美国FIME、南非医疗展、俄罗斯医疗展等全球70多个海外医疗展览及会议。携手全球各大展览主办方,每年组织约5000家中国医疗企业及专业医疗机构参与,提供参展、代参展、观展、商务行程、签证、政府补贴协助等专业、精致、贴心的服务助力企业开拓全球市场。







